रदरफोर्ड के परमाणु मॉडल की कमियों को नील बोर ने प्लांक के क्वाण्टम सिद्धान्त के आधार पर सन् 1913 में दूर किया। इसके लिए उन्होंने निम्नलिखित तीन नये अभिगृहीत (postulate) प्रस्तुत किये
बोर की परिकल्पनाएँ।
(i) इलेक्ट्रॉन नाभिक के चारों ओर केवल उन्हीं कक्षाओं में घूम सकते हैं जिनके लिए उनका कोणीय संवेग h/2π का पूर्ण गुणज हो,
अर्थात् Iω = mrnνn) = nh/2π
जहाँ I इलेक्ट्रॉन की nवीं कक्षा में जड़त्व-आघूर्ण तथा ω कोणीय वेग है। पूर्णांक n = 1, 2, 3, … तथा h प्लांक नियतांक है। इस प्रकार बोर ने माना कि इलेक्ट्रॉन नाभिक के चारों ओर कुछ निश्चित त्रिज्या की कक्षाओं में ही घूम सकते हैं। इन कक्षाओं को स्थायी कक्षाएँ (stationary orbits) कहते हैं।
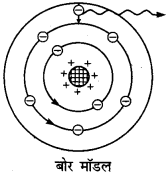
(ii) स्थायी कक्षाओं में घूमते समय इलेक्ट्रॉन ऊर्जा का उत्सर्जन नहीं करते। अतः परमाणु का स्थायित्व बना रहता है।।
(iii) जब परमाणु को बाहर से ऊर्जा मिलती है तो उसका कोई इलेक्ट्रॉन उसे ग्रहण कर ऊँची कक्षा में चला जाता है। यह परमाणु की उत्तेजित अवस्था कहलाती है। इलेक्ट्रॉन ऊँची कक्षा में केवल 10-8 सेकण्ड तक ठहर कर तुरन्त वापस किसी भी नीची कक्षा में लौट आता है और लौटते समय दोनों कक्षाओं की ऊर्जा के अन्तर के बराबर ऊर्जा वैद्युत-चुम्बकीय तरंगों के रूप में उत्सर्जित करता है। यदि उत्सर्जित तरंगों की आवृत्ति ν हो तथा इलेक्ट्रॉन की उच्च कक्षा में ऊर्जा E2 तथा नीची कक्षा में ऊर्जा E1 हों, तो ,

अत: ऊर्जा का उत्सर्जन केवल तभी तक होता है जब तक कि कोई इलेक्ट्रॉन किसी निश्चित ऊँची कक्षा से नीची कक्षा में लौटता है। इस प्रकार परमाणु से केवल कुछ निश्चित आवृत्तियों (तरंगदैर्घ्य) की तरंगें उत्सर्जित होती हैं जो रेखीय स्पेक्ट्रम देती हैं। इस प्रकार परमाणु के बोर मॉडल के आधार पर हाइड्रोजन के स्पेक्ट्रम की व्याख्या की गई।
हाइड्रोजन परमाणु की प्रथम कक्षा की त्रिज्या के लिए व्यंजक:
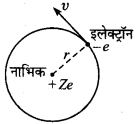
हाइड्रोजन-सदृश परमाणु में एकल इलेक्ट्रॉन परमाणु के इलेक्ट्रॉन नाभिक के चारों ओर एक स्थायी कक्षा में घूमता है। माना कि e, m वे ν इलेक्ट्रॉन के क्रमश: आवेश, द्रव्यमान व वेग हैं तथा कक्षा की त्रिज्या है। (हाइड्रोजन नाभिक पर धनावेश Ze है, जहाँ,Z परमाणु-क्रमांक है (हाइड्रोजन परमाणु के लिए Z = 1)। इलेक्ट्रॉन को अपनी कक्षा में घूमने के लिए आवश्यक अभिकेन्द्र बल, नाभिक व इलेक्ट्रॉन के बीच स्थिर वैद्युत आकर्षण-बल से प्राप्त होता है। अतः